De Frente al Campo TV Online Federal

INTRODUCCIÓN
La terapéutica con fármacos en bovinos ha crecido mundialmente incorporándose cada día más a la prevención, control y tratamiento de patologías. Sin embargo, lo que ha sucedido en el mundo, pudiera ser distinto en algunos países, donde actualmente existen limitaciones para que ingresen ciertos medicamentos veterinarios o por el contrario circulan y se emplean principios activos de uso restringido sin prescripción veterinaria, lo que suele promover en medicina bovina a que se administren fármacos a bovinos que son destinados oficialmente a otras especies, o para tratar enfermedades diferentes a las que se indican en patentes registradas, o suele administrarse un fármaco a dosis superiores a la autorizada para la especie destinada. Estos tres últimos argumentos entran en la definición de Uso Extraindicado de los Fármacos (UEIF) y al menos uno o más de los tres se han ejecutado en la farmacoterapéutica de nuestros rebaños. El UEIF permite al veterinario adaptar el uso y dosificación de fármacos a las cambiantes condiciones clínica–terapéuticas que se suelen dar en la práctica (Arboix y Martin-Jiménez, 2002).
Un incremento de fármacos asequibles y/o la modificación de antiguos principios activos por las patentes fabricantes, establece mayores responsabilidades veterinarias, debido a nuevas: contraindicaciones (situaciones específicas en las que no se debe utilizar un fármaco por ser nocivo), efectos colaterales (efectos indeseados por la acción principal del medicamento), periodo de retiro (intervalo de tiempo desde la última administración del medicamento a la especie de destino, en condiciones normales de uso, hasta que los tejidos destinados al consumo humano alcancen niveles iguales o inferiores a los límites máximos de residuos [LMR] fijados), e interacciones con otros fármacos (Arboix y Martin-Jiménez, 2002).
Una interacción farmacológica ocurre cuando un fármaco modifica la actividad o efecto de otro por su administración simultánea o no (Mealey, 2002), y también cuando en su exposición coins pudiendo obtenerse efectos sinérgicos (aditivos o potenciación) y antagónicos (opuestos) que pueden ser adversos o benéficos (Lees et al., 2004). Es decir, para que exista una interacción entre medicamentos deben coincidir al menos dos o más fármacos, pues un solo medicamento no es capaz de generar efectos por interacciones medicamentosas.
Las interacciones farmacológicas adversas (IFA) dependerán de los fármacos administrados, del animal y su ambiente. Una interacción se considera adversa primero: cuando los fármacos evitan efectos terapéuticos en la enfermedad (ejemplo: por subdosificación, neutralización o inactivación entre fármacos), para la que se utilizan, o segundo: cuando incrementen su toxicidad, ejemplo: disminución del índice terapéutico (IT): margen de seguridad entre la dosis del medicamento que causa toxicidad/muerte y la dosis que causa el efecto deseado en un número de animales (Anadón, 1994; Martin-Jiménez, 2002).
El impacto de las IFA en ganadería bovina es primordialmente sobre la rentabilidad productiva, pudiendo conducir al riesgo de muerte súbita o al deterioro del rebaño por toxicidad crónica. Esto puede complicar ciertos cuadros clínicos y su desempeño zootécnico de manera silente, pero también obtener escaso o ningún efecto terapéutico, incrementando el periodo y costo de la farmacoterapéutica. Concomitantemente, esto aumentaría la exposición de animales a algunos medicamentos, promoviendo la incorporación de residuos de fármacos a la cadena agroalimentaria, contribuyendo a mermar la calidad e inocuidad de alimentos (carne y leche) destinados a consumo humano. Este articulo tiene el objetivo de describir las IFA más frecuentes en rebaños bovinos y sus consecuencias, con el fin de prevenir su ocurrencia en tratamientos multimedicamentosos al realizar terapéuticas sin consultar al médico veterinario, quien está facultado para distinguir los auténticos riesgos y necesidades de indicar uno o más fármacos en la medicación de los animales o rebaños.
CONCEPTOS Y TÉRMINOS EMPLEADOS EN FARMACOTERAPÉUTICA
A continuación describiremos algunos términos aplicados en farmacoterapéutica veterinaria, necesarios para comprender las IFA en medicina de bovinos según Martin-Jiménez (2002).
- Área bajo la curva (ABC): Representa el nivel (mayor o menor) de exposición del organismo (vertebrado) a un fármaco determinado.
- Biodisponibilidad: Cantidad de fármaco que alcanza uno de los compartimientos farmacológicos del total que fue administrado por una vía determinada.
- Liposolubilidad: Representa el grado de facilidad para la difusión pasiva de los fármacos a través de las barreras biológicas.
- Ionización: Se define ionización como el fenómeno químico o físico mediante el cual se producen iones, estos son átomos o moléculas cargadas eléctricamente debido al exceso o falta de electrones respecto a un átomo o molécula neutra. La mayoría de los medicamentos son ácidos o bases débiles, que en solución se encuentran en forma ionizada (polar) y no ionizada. La porción no ionizada de los fármacos es usualmente liposoluble (no polar) y por lo tanto puede atravesar las membranas, permaneciendo más tiempo en los tejidos o compartimientos del animal. La fracción ionizada (poco liposoluble o más polar), por su escasa solubilidad en lípidos (hidrosoluble), no puede atravesar las membranas celulares o lo hace escasamente, permaneciendo menos tiempo en los tejidos o compartimientos del animal.
- pKa de un fármaco: Es el pH al cual un fármaco tiene la mitad de sus moléculas ionizadas y la mitad de sus moléculas no ionizadas, es decir, se encuentran en equilibrio, teniendo más oportunidad de absorberse la mitad no ionizada (más liposoluble o no polar).
- Semivida o vida media de un fármaco (t1/2): Es el tiempo necesario para eliminar del organismo el 50% del fármaco administrado.
- Xenobiótico: Es un compuesto ajeno al cuerpo. Se aplica a los compuestos cuya estructura química en la naturaleza es poco frecuente o inexistente debido a que son sintetizados por el hombre en el laboratorio (ejemplo algunos medicamentos, plaguicidas o contaminantes sintéticos).
CLASIFICACIÓN DE LAS INTERACCIONES FARMACOLÓGICAS
Según el mecanismo por el que ocurre una interacción entre fármacos, éstas pueden deberse a causas farmacéuticas (fisicoquímicas), farmacocinéticas o fármacodinámicas. Este artículo dedicará mayor contenido a las de tipo farmacocinéticas con respecto a las otras dos, por el mayor impacto en rebaños bovinos (tabla 1) citando algunos ejemplos experimentales, sólo con el fin de facilitar su compresión.
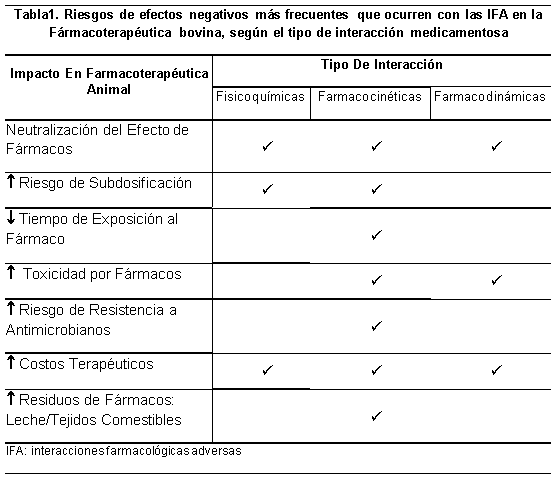
1. Interacciones Farmacológicas Adversas: Farmacéuticas o Fisicoquímicas
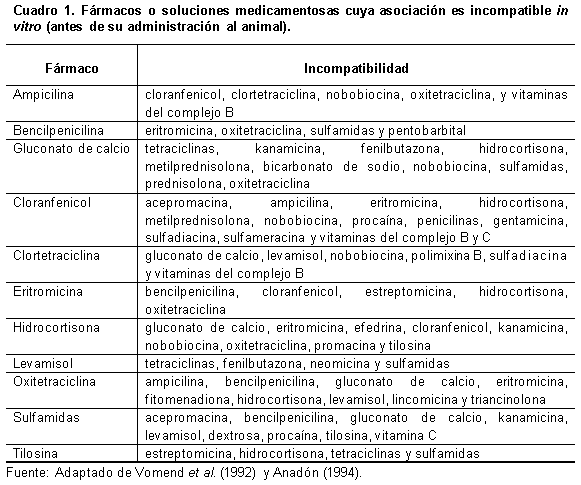
Son aquellas que comprenden la asociación de dos o más fármacos, incompatibles para su administración en conjunto con anulación de su(s) efecto(s) por razones físicas, químicas o ambas, al modificar mediante neutralización, inactivación, insolubilización o precipitación los medicamentos (Mealey, 2002). Generalmente suelen ocurrir antes de ser administradas al animal, un ejemplo es la incorporación de más de un fármaco dentro de una inyectadora o mezclados en recipientes de soluciones para administrarlas con equipos de venoclisis. Se debe esperar una incompatibilidad potencial entre fármacos cuando el pH final de la mezcla de varios componentes es muy diferente al pH de cada fármaco incluido, resultando primordialmente una inactivación (Anadón, 1994), ejemplo de ello es ceftiofur en solución salina que resulta en una precipitación, debido a la incompatibilidad físico-química de este fármaco cuando se mezcla o diluye con la mencionada solución. En medicina bovina estas interacciones se consideran adversas en aquellos casos que no se cumple la terapéutica del paciente. El Cuadro 1, muestra algunos ejemplos de interacciones farmacéuticas.
Otro ejemplo asociado con la incompatibilidad fisicoquímica de algunos principios activos se corresponde al antiparasitario amitraz y el agua como vehículo para administrarlo al rebaño mediante baños ectoparasiticidas. Este fármaco puede ser afectado cuando el agua utilizada como solvente para preparar la solución de baño desparasitante presenta un pH ácido, pudiendo neutralizar el amitraz evitando el efecto esperado en el control de garrapatas. Para mejorar su estabilidad y obtener mejores resultados en su efecto garrapaticida, el amitraz debe prepararse con agua alcalinas con un pH sugerido de 12 (Muñoz, 2002).
Interacciones Farmacológicas Adversas: Farmacocinéticas
Son modificaciones en el efecto de fármacos debido a la administración conjunta de otro(s) por cambios en su absorción, distribución/transporte, metabolización o excreción, (Mealey, 2002). Fundamentalmente cambian la concentración de fármacos en el animal entre otros valores y propiedades (biodisponibilidad, semivida, concentración en sangre, volumen de distribución, ABC), de los fármacos establecidos para la especie.
Interacciones en la absorción de fármacos en tracto gastrointestinal (TGI)
Éstas suelen restringirse a fármacos de administración oral y son más comunes en becerros (Vomend et al., 1992), primordialmente debido a que los microoganismos del rumen dificultan la administración oral, al interferir con la biodisponibilidad y absorción de varios fármacos, así como, por limitaciones prácticas de manejo al administrarlos vía oral al rebaño. El proceso de absorción para fármacos permite alcanzar la circulación desde el TGI, sin embargo, éste puede ser dependiente del pH y pKa del fármaco (Martin-Jiménez y Papich, 2002). Otros factores son los fármacos que pueden interaccionar con iones específicos en el TGI, produciendo complejos no absorbibles. La interacción Ca++ (entre otros cationes di o trivalentes) y tetraciclinas (Lemos, 2002), es un ejemplo clásico (no tan frecuente en medicina bovina), cuando estos antibióticos se administran oralmente con gluconato de calcio o en animales recientemente amamantados, pudiendo disminuir la absorción del fármaco. La presencia o no de alimento en el TGI y el contenido del mismo puede modificar la eficacia de antihelmínticos orales (Cuadro 2), como los bencimidazoles (Sánchez et al., 2002).
La terapia anticolinérgica (con sulfato de atropina), frecuente en intoxicación por plaguicidas órgano-fosforados, puede retrasar el vaciamiento gástrico (Anadón, 1994) pudiendo modificar por ejemplo el ritmo de absorción de sulfamidas o monensina utilizados vía oral en producción (promotor de crecimiento) y medicina (coccidioestático y alteraciones del TGI) de bovinos. Los medicamentos utilizados en diarreas, como caolín, pectina, carbón activado, sulfato de bismuto, pueden restringir la absorción de algunos antibióticos, aminoácidos, vitaminas y minerales, sobre todo en el caso del carbón activado y otras moléculas con capacidad adsorbente o secuestrante (Honrubia y Botana, 2002).

Interacciones en la distribución y transporte de fármacos
Una vez adsorbidos, los fármacos se distribuyen a través de la sangre en los diversos tejidos del animal. La distribución de fármacos dependerá de su liposolubilidad, flujo sanguíneo tisular, grado de afinidad para unirse a proteínas plasmáticas (PP), entre otros (Martin-Jiménez, 2002). Ciertos fármacos comparten un número limitado de lugares de unión a PP, pudiendo un fármaco desplazar a otro incrementado su fracción libre (fármaco no unido a PP), en ocasiones con consecuencias graves debido a que la fracción libre es responsable de los efectos farmacoterapéuticos y/o tóxicos según la concentración plasmática que alcance (Anadón, 1994). Los anti-inflamatorios no esteroideos (AINE) tienen alta afinidad (>95 %) a los sitios de unión en las PP, su administración simultánea con otro fármaco que se una ampliamente en plasma a PP, pero cuya afinidad por estas últimas sea menor que la del AINE (Cuadro 3), podría incrementar los niveles sanguíneos del fármaco administrado conjuntamente (riesgo de incremento de fracción libre del fármaco en plasma o tejidos), ampliando los efectos terapéuticos o tóxicos de este último (Martin-Jiménez y Papich, 2002); a pesar de administrarlos a las dosis correctas.
El significado clínico de estas IFA depende del régimen terapéutico (tiempo de administración del AINE), la relevancia del proceso clínico tratado y estado del paciente (Martin-Jiménez y Papich, 2002), por ejemplo, animales con inanición prolongada, desnutrición global crónica o que presenten hipoproteinemia, pueden tener mayor riesgo de toxicidad con la administración de AINE conjuntamente con otro(s) AINE, ciertos antibióticos (Cuadro 3) y medicamentos esteroides (antiinflamatorios o anabolizantes hormonales) por incremento de la fracción libre de estos medicamentos adicionales, desarrollando posiblemente alteraciones subagudas a crónicas por daño renal (sobre todo con aminoglucósidos) o hepático (entre otros tejidos) pudiendo comprometer el desempeño productivo de los animales manera crónica o aguda según el caso. Asimismo, el incremento de la fracción libre de ciertos antibióticos, puede influir el periodo de retiro y los LMR en leche o tejidos comestibles.

En los mecanismos transportadores de fármacos a nivel celular, se describe frecuentemente la glicoproteína-P (gp-P) y en medicina veterinaria algunos fármacos como eritromicina, dexametasona y antiparasitarios del grupo de las lactonas macrocíclicas (LM), como la ivermectina (IVN), moxidectina (MXA), entre otros, que pueden utilizar o competir por este transportador si se administran conjuntamente en el animal (Cuadro 4), pudiendo acelerar o retrasar la excreción de uno de ellos intracelularmente según el tejido y su afinidad por la gp-P (Ballent et al., 2005; Chang, 2007; Lespine et al., 2007).

En ovejas se comparó el efecto de itraconazol sobre la concentración en plasma sanguíneo de IVN administrándola vía intravenosa e intraruminal, no obstante, las concentraciones plasmáticas de IVN vía intravenosa no se modificaron por la presencia de itraconazol. Mientras que cuando la IVN se administró vía intraruminal las concentraciones plasmáticas aumentaron en el grupo que se coadministró itraconazol, en comparación con los animales sin itraconazol, demostrándose que la biodisponibilidad de IVM aumentó significativamente debido a una inhibición de la gp-P de las células intestinales (Ballent et al., 2007). Esta fármaco-modulación de la gp-P, sugiere que puede promover mayor concentración y semivida de IVN en rumiantes en asociación con otros fármacos con afinidad por estas proteínas de trasporte (cuadro 4). No obstante, se sugiere que en algunos nemátodos, su propia gp-P, podría participar en su alto grado de resistencia a IVN al regular la entrada y salida de sus células, tras la exposición prolongada a LM (Lifschitz et al., 2010; De Graef et al., 2013).
La importancia práctica de estos experimentos es sobre la necesidad del adecuado uso de fármacos como IVM y otras LM, basado en la indicación del veterinario facultado, ya que, aun cuando las LM tienen amplio IT en bovinos, la probabilidad de sobrepasarlo sería mayor en presentaciones cuya concentración de IVM sea mayor al 1% (≥ 3.15 % por ejemplo), sobre todo en animales con menor desarrollo, bajo peso o menor grasa corporal (según el componente racial) debido a que la grasa acumula importantes cantidades de varias LM influyendo en la persistencia de éstas en el animal (Lifschitz et al., 2002). Asimismo, estas interacciones pueden prolongar la semivida o permanencia tisular de IVM, y posiblemente se estaría promoviendo aparición de parásitos resistentes en rebaños (De Graef et al., 2013), haciendo a largo plazo poco rentable la terapéutica con IVM u otras LM y probablemente habrá mayores residuos de éstas en leche y tejidos para consumo humano.
Interacciones en el metabolismo o biotransformación de fármacos
Muchas IFA se deben a enzimas metabolizantes de fármacos a nivel hepático (entre otros órganos) de la superfamilia de oxidasas de función mixta Citocromo P-450 (CYP), quienes con frecuencia biotransforman fármacos para facilitar su eliminación (Martin-Jiménez, 2002). Generalmente transforman fármacos del estado liposoluble (baja polaridad) a hidrosoluble (alta polaridad), para ser excretados en fluidos y excreciones corporales por su mayor afinidad al agua (hidrofilia), debido a que al permanecer liposolubles los fármacos y sus metabolitos serán menos polares (hidrofóbicos) y tendrán menor posibilidad de ser eliminados del animal. Varios fármacos son metabolizados por enzimas CYP, siendo algunos capaces de inhibir (interferir o bloquear) o inducir (promover o incrementar) su actividad enzimática (Mealey, 2002).
Los fármacos inhibidores (Cuadro 4), suelen hacer más lento el metabolismo hepático de otros fármacos distintos administrados conjuntamente. Esto puede prolongar la semivida de fármacos incrementándose su eficacia terapéutica, al aumentar sus concentraciones plasmáticas, pero también puede potenciar sus efectos tóxicos (Fink-Gremmels, 2008).
El cloranfenicol, está prohibido en animales de consumo, pero indebidamente suele administrarse en algunas explotaciones bovinas (Briceño et al., 2008), puede inhibir el metabolismo hepático de la monensina, originando en el animal mayores niveles de monensina y pudiendo existir riesgo de toxicidad clínica o subclínica por este último fármaco (Lemos, 2002). Se ha reportado toxicidad fatal con la administración conjunta de cloranfenicol y levamisol, posiblemente debido al efecto inhibidor del cloranfenicol sobre el metabolismo del levamisol, considerando que este último es metabolizado extensamente en el hígado. Asimismo, El butóxido de piperonilo (BOP) se añade a ectoparasiticidas tipo piretrina, piretroides y carbamatos. El BOP es un potente inhibidor y retarda el metabolismo de ciertos antihelmínticos bencimidazoles (Cuadro 2; Sánchez et al., 2002).
En la práctica, la exposición del rebaño a estos ectoparasiticidas con BOP debe ser considerada al momento de aplicar tratamientos con fármacos que se metabolicen en el hígado, al igual que con otros medicamentos inhibidores de enzimas CYP (Cuadro 4). El efecto primordial de esta IFA es el incremento de concentraciones plasmáticas de aquellos fármacos cuyo metabolismo este interferido por otro medicamento o xenobiótico, pudiendo obstaculizar su eliminación y disminuir su IT, causando toxicidad al animal. Esto dejaría mayores residuos de ciertos fármacos en leche y tejidos comestibles, debiendo recomendarse prolongar el periodo de retiro del fármaco correspondiente para restringirlo en la cadena agroalimentaria.
Otros grupos de fármacos son capaces de incrementar la actividad de enzimas CYP, lo que es definido como inducción enzimática (Martin-Jiménez, 2002). Usualmente se acelera la biotransformación hepática de un fármaco haciéndolo más polar, siendo más fácilmente eliminado en líquidos y excreciones corporales en un periodo de tiempo menor con respecto al establecido para el fármaco en la especie animal en la que se administró. El efecto inductor enzimático (EIE) suele ser muy variable entre animales, debido a que generalmente se requieren previas exposiciones prolongadas o frecuentes a los fármacos o xenobióticos inductores enzimáticos (Cuadro 4) presentes en el ambiente de los rebaños (Anadón, 1994; Fink-Gremmels, 2008). La mortalidad en ratas inoculadas con Tripanosoma evansi, expuestas previamente (dos veces al día, durante 7 días continuos) a fenobarbital (inductor) y a las que se les administró posteriormente aceturato de diminazeno como tripanocida, incrementó significativamente con respecto al grupo que no recibió fenobarbital (Arrieta et al., 2007).
En rumiantes las concentraciones plasmáticas de fenilbutazona pueden ser menores a las previstas cuando se administra en forma continua a intervalos regulares, probablemente debido al EIE que este AINE puede generar sobre su propio metabolismo hepático y otros AINE, no obstante, este fármaco puede inducir o inhibir (Cuadro 4) el metabolismo de otros según la frecuencia de administración (Martin-Jiménez y Papich, 2002). Los residuos de xenobióticos inductores, tales como organoclorados (actualmente restringidos en varias regiones del planeta por su impacto ambiental y su toxicidad residual), se han reportado en productos lácteos de la industria bovina (Izquierdo et al., 2004).
Otros inductores, como los organofosforados están disponibles en la agroindustria y con frecuencia son utilizados para el control de moscas en bovinos, entre otros ectoparásitos. Posiblemente el EIE de estos compuestos promueve que los rebaños presenten mayor riesgo a enfermedades causadas por patógenos resistentes a ciertos medicamentos anti-infectivos, en razón de que, aquellos fármacos (antibióticos o antiparasitarios) que se metabolicen más rápido dentro del animal por el EIE, tendrán concentraciones subterapéuticas del mismo en sangre o tejidos, aumentando la probabilidad de aparición de resistencia a estos fármacos en algunos microorganismos (bacterias, hongos y protozoarios) y helmintos, quienes tendrán menor exposición a concentraciones efectivas de las drogas, favoreciendo la aparición de resistencia a las mismas, disminuyendo la rentabilidad de su uso en bovinos. No obstante, las consecuencias de estas IFA pueden prevenirse siguiendo las debidas indicaciones del médico veterinario facultado para tomar las decisiones sobre tratamientos con terapias multimedicamentosas en bovinos.
Interacciones en la excreción de fármacos
En medicina veterinaria, la reabsorción tubular renal es el mecanismo que fundamentalmente participa en IFA, que consiste principalmente en recaptar fármacos que son ácidos débiles o bases débiles desde la orina a la sangre, estando ampliamente influenciado por el estado de ionización (polar o no polar) del compuesto en la orina (Anadón, 1994; Martin-Jiménez, 2002). Por lo que toda terapia que incremente el pH de la orina por ejemplo, uso de bicarbonato de sodio en casos de acidosis ruminal (Jordan y Aguilar, 1985), disminuirá la liposolubilidad (mayor polaridad) de ácidos débiles y su reabsorción desde la orina a la sangre, favoreciendo su excreción urinaria. Esto por el contrario aumentará la liposolubilidad de bases débiles y la semivida de estos fármacos al disminuir su excreción. En el Cuadro 5 se presenta una clasificación de fármacos según sean ácidos o bases débiles.

Las terapias o dietas que conduzcan a acidificar o disminuir el pH de la orina, ejemplo de ello es la suplementación prolongada con cloruro de amonio (compuesto común en sales minerales comerciales), incrementarán la semivida de fármacos ácidos débiles facilitando su reabsorción desde la orina a la sangre. Contrariamente, la acidificación de la orina disminuirá la semivida de los fármacos bases débiles (Anadón, 1994; Martin-Jiménez, 2002). Por ejemplo ácidos débiles tales como: estreptomicina, AINE y algunas sulfamidas (sulfadiacina y sulfadiamidina), se excretarán más rápidamente a pH urinario alto y más lentamente a pH urinario bajo (Anadón, 1994). Adicionalmente, se describe que el pH de la orina puede ser ácido en herbívoros con régimen de alimentación balanceada (alimento comercial) o animales en estado de ayuno prolongado, favoreciendo estas condiciones la eliminación de aquellos fármacos bases débiles, por lo que estos serán menos eficaces. Por el contrario el pH alcalino de la orina en animales herbívoros con régimen de alimentación a pastoreo, facilita la eliminación en orina de fármacos ácidos débiles (Anadón, 1994). En la práctica diaria estas IFA se pueden prevenir con asesoramiento del médico veterinario, quien debe informarse de la terapéutica previa de un animal, las particularidades en su manejo alimentario y conocer las propiedades químicas del medicamento (bases débiles o ácidos débiles por ejemplo), antes de decidir administrar otro medicamento.
Interacciones Farmacológicas Adversas: Farmacodinámicas
Estas interacciones están asociadas al mecanismo de acción de los fármacos, es decir, se manifiestan generalmente por una modificación en la respuesta del órgano en que actúan por la administración de otro medicamento, pudiendo producirse activación o inhibición, entre otros efectos inespecíficos (Honrubia y Botana 2002; Lees et al., 2004;). Por ejemplo la asociación de AINE y anti-inflamatorios esteroideos (prednisolona o dexametasona) puede potenciar la toxicidad gastrointestinal o renal (Honrubia y Botana 2002) por bloqueo y no expresión de COX-1 (ciclooxigenasa constitutiva citoprotectora) primordialmente. La administración simultánea de anti-inflamatorios esteroideos con las tetraciclinas (oxitetraciclina y clortetraciclina, entre otras) puede conducir a una elevación anormal de compuestos nitrogenados en la sangre (azoemia) debido a la degradación excesiva de proteínas, conduciendo a pérdida de peso en animales débiles o con inadecuada alimentación (Lemos, 2002).
La asociación de los compuestos organofosforados (triclorfón, malatión, entre otros) y carbamatos (propoxur, carbaril, neostigmina) inhibidores de la enzima acetilcolinesterasa (CIAchasa), con desparasitantes antihelmínticos de acción nicotínica (levamisol por ejemplo), puede aumentar la toxicidad del levamisol (utilizado en la terapia antihelmíntica bovina), debido a sobre-estimulación en receptores colinérgicos, promovida por los CIAchasa (Sánchez et al., 2002).
En fármacos como el dipropionato de imidocarbo (carbanilida derivada de las diamidinas) utilizado en el control de babesiosis y anaplasmosis bovina, se reporta que presenta bajo índice terapéutico con alta acumulación en tejidos y prolongada semivida en bovinos, describiéndose efectos colinérgicos (salivación excesiva, temblores, ataxia, entre otros) con dosis superiores a las terapéuticas (Álvares et al., 2002). El uso de este medicamento en rebaños expuestos a CIAchasa o junto con levamisol, posiblemente incrementaría la actividad colinérgica en animales sometidos a esta farmacoterapia.
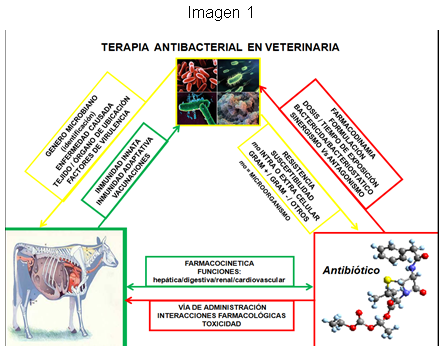
En antibioterapia efectiva se debe considerar varios aspectos (Imagen 1), entre los cuales están la información sobre: el agente etiológico (bacteria u otros microoganismos), causante de la infección, cual? tejido(s) está afectado en el rumiante y que? antimicrobiano(s) se utilizará(n) para contrarrestar la patología. Este último factor requiere reconocer las interacciones farmacológicas posibles entre antimicrobianos y otros medicamentos. A continuación se resumen algunas interacciones entre antibióticos indeseables en medicina bovina, en razón de que por ser un tema complejo y con diversidad de antagonismos y sinergismos según el ambiente, patología y régimen terapéutico de cada caso, ameritaría un capítulo aparte debido a la importancia agroalimentaria del mismo.
Todos los antimicrobianos macrólidos, el cloranfenicol y las lincosamidas comparten prácticamente el mismo sitio de unión (subunidad ribosómica 50 S) para bloquear la síntesis de proteína en bacterias, por lo que estos antibióticos se interfieren (antagonismo) unos a otros en su acción antibacteriana, sin conseguir los efectos terapéuticos esperados. Asimismo, también se describe que la utilización de macrólidos, tetraciclinas y cloranfenicol, por separado, pero junto con ß-lactámicos (especialmente penicilina y ampicilina) es incompatible, debido a que interfieren (antagonizan) con el efecto bactericida (inhibición de síntesis de su pared) de ß-lactámicos en bacterias Gram positivas (Lemos, 2002). Estas interacciones antagónicas dependerán de las características fisicoquímicas y espectro de acción de los antibióticos, según si la infección del animal es por bacterias Gram positivas (tienen pared celular) o Gram negativas (carecen de pared celular), o la infección es por ambos grupo de bacterias. Adicionalmente, esta información sugiere que en antibioterapia bovina las combinaciones de otros fenícoles (florfenicol y tianfenicol) con macrólidos entre sí, o de estos con lincosamidas, probablemente tendrán un efecto antagónico, es decir, no tendrán el efecto deseado en el tratamiento del animal.
CONCLUSIÓN
Las IFA pueden evitar la corrección de los procesos patológicos en el rebaño y en ocasiones complicarlos, dificultando el desempeño zootécnico de los animales e incrementando los costos de operatividad. Adicionalmente, las IFA pueden favorecer la aparición de gérmenes o patógenos resistentes a medicamentos (particularmente en las farmacocinéticas), con mayor impacto sobre el ambiente animal y sobre la cadena agroalimentaria al promover mayores residuos tisulares, así como, una excreción retardada de los principios activos o xenobióticos en leche y carne destinados al consumo humano. Por estos motivos, es fundamental la participación de los productores y del médico veterinario facultado, quien debe ser consultado antes de realizar o tomar decisiones inherentes a la aplicación de fármacoterapias multimedicamentosas en los rebaños bovinos.
Finalmente se considera hacer una reflexión, recordando que un bisturí es un instrumento quirúrgico capaz de contribuir en la terapéutica y el bienestar animal, pero sólo en las manos capacitadas y documentadas profesionalmente, mientras que en otras manos, un bisturí puede tener efectos o resultados muy distintos sobre el animal, así pues, “un fármaco debe ser considerado un bisturí” en razón de que solo el profesional facultado podría utilizar uno o más fármacos de la manera indicada para contribuir en la salud animal y así prevenir las IFA y su impacto negativo sobre la terapéutica bovina, los costos y la cadena agroalimentaria.

















































