RESUMEN
Introducción: La tuberculosis bovina (TBb) es una enfermedad zoonótica, cuyo agente etiológico es Mycobacterium bovis.La TBb representa un grave problema de salud animal, causando pérdidas económicas. La inmunidad mediada por células (IMC), representa el mecanismo más importante de la inmunidad adquirida. En esta hay interacciones entre antígenos micobacterianos y células presentadoras de antígenos, esto provoca la producción de citocinas que activan a macrófagos y linfocitos T.
El objetivo de este estudio fue determinar el patrón de expresión de citocinas Th1 y Th2 en bovinos vacunados con BCG y extracto proteico de filtrado de cultivo (CFPE). Materiales y Métodos: 24 hembras Holstein-Friesian de 6 meses de edad, negativas a las pruebas diagnósticas de TBb, se dividieron en cuatro grupos (6 animales/grupo): control no vacunado, vacunado con BCG, vacunado con CFPE de M. bovis AN5 y vacunado con IFN-γ recombinante más CFPE. La expresión de citocinas IFN-γ, IL-2, IL-4 e IL-10 se evaluó por RT – PCR y se representó como el porcentaje de la intensidad relativa de las bandas correspondientes a los productos de amplificación, con respecto al control positivo interno (β-actina), utilizando el software LabsWorks 4.0.
La respuesta inmune celular, se evaluó mediante la producción de IFN-γ en cultivo de células estimuladas con PPD bovino y PPD aviar a diferentes tiempos. Resultados: el grupo vacunado con BCG, mostró niveles altos de producción de IFN-γ, en comparación al resto de los grupos. La expresión de IFN-γ por medio de RT-PCR, se observó con los diferentes antígenos específicos empleados, en mayor proporción que IL-2, durante todo el experimento; el patrón de respuesta preferentemente fue Th1, sobre todo después del desafío en el grupo vacunado con IFN-γ+CFPE, sin embargo no fue el tipo de respuesta predominante, ya que presentó una respuesta Th2. Conclusiones: Las vacunas con BCG o CFPE pueden ser alternativas altamente viables para el control de la TBb.
Introducción
La tuberculosis bovina (TBb), es una de las enfermedades zoonóticas más importantes a nivel mundial, representa un serio problema de salud pública, además de causar graves pérdidas económicas a la industria ganadera-lechera [1]. Para poder reducir las prevalencias/incidencias de TBb, algunos países han implementado programas de control y erradicación, basados principalmente en la realización de las pruebas de intradermorreacción (PID), con la eliminación y sacrificio de los animales reactores [2], pero constantemente se buscan alternativas que permitan el control, sin que represente el sacrifico del ganado.
Una de estas opciones es el empleo de vacunas que protejan a largo plazo y controlen la TBb [3, 4]. La vacuna de BCG aplicada en humanos, se originó a partir de una cepa de M. bovis virulenta proveniente de un caso de mastitis bovina en el año de 1908. La BCG se ha aplicado en humanos, desde 1921 esto la convierte en la vacuna más utilizada a nivel mundial, en el campo de la salud humana (5, 6, 7). En el caso de bovinos, se han desarrollado vacunas a nivel experimental, con dosis medias y altas (106 y 109 unidades formadoras de colonias, UFC) de BCG M. bovis, y al ser evaluadas, evocan la secreción de citocinas como IFN-γ e IL-2 que dan cierta protección contra la TBb; sin embargo, pueden interferir con el método de diagnóstico convencional como la PID.
Por tal motivo, se busca una vacuna que pueda utilizarse para controlar la enfermedad, que no interfiera con el diagnóstico y que su aplicación en los animales sea práctica [8]. Otras de las alternativas como vacuna han sido las proteínas presentes en los extractos proteicos de filtrado de cultivo (CFPE) de M. bovis o M. tuberculosis, que han mostrado ser potentes estimuladores de células T, tanto en modelos de ratones como en bovinos (9), la razón de usar estos CFPE, es debido a que no inducen la reactividad a la PID, no interfiriendo con las pruebas diagnósticas y la efectividad de la vacuna no se ve influenciada por previa sensibilización de micobacterias ambientales (10).
Los antígenos específicos que evocan la inmunidad protectora por los linfocitos Th1 aún no están bien definidos; sin embargo, se ha observado que las vacunas vivas (BCG), son más eficientes en la generación de la inmunidad adquirida, comparada con las preparaciones de micobacterias muertas (11). Con lo anterior, se muestra que dependiendo del antígeno producido por la micobacteria será el tipo de respuesta esperada. La vacunación podría ser una opción contra la TBb, sobre todo en zonas donde las prevalencias/incidencias son altas y primordialmente en cuencas lecheras, que no pueden costear programas clásicos de control y erradicación. El objetivo de este trabajo fue evaluar la eficacia de la BCG y del CFPE de M. bovis como inmunógenos contra la TBb a través del monitoreo del IFN-γ, evaluación de citocinas Th1 (IFN-γ, IL-2), Th2 (IL-4, IL-10) y presencia de lesiones macroscópicas a la necropsia.
Materiales y métodos
Declaración de ética. El diseño del estudio, metodología del muestreo, desafío y sacrificio fueron revisados y aprobados por el Comité de Bioética para el Cuidado y Uso de Animales para Experimentación en Proyectos de Investigación del Centro Nacional de Investigación Disciplinaria en Microbiología Animal (CENID-Animal Microbiología) del Instituto Nacional de Investigación Forestal, Agrícola y Pecuaria (INIFAP). La recolección de muestras de sangre y la administración de la prueba de tuberculina comparativa intradérmica (SICTT), siguiendo los procedimientos oficiales de la Norma Oficial Mexicana (NOM-041-ZOO1995) de la Campaña Nacional contra la tuberculosis (12).
Diseño experimental. Se utilizaron 24 hembras de la raza Holstein-Fresian de 6 meses de edad, procedentes de una zona libre de TBb, confirmada su negatividad a la infección, por la prueba cervical comparativa (PPC), interferón gama (IFN-γ), inmunoensayo (ELISA) y la reacción en cadena de la polimerasa (PCR) a partir de muestras de moco nasal. Los animales fueron divididos en 4 grupos (6 animales/grupo); grupo 1 control, se inocularon con solución de fosfatos estéril pH 7.0 (PBS); grupo 2, vacunados con BCG M. bovis cepa Pasteur (1×105 UFC); grupo 3 inoculados con 300 µg de CFPE de M. bovisAN5; grupo 4 se inocularon con 200 ηg de IFN-γ bovino recombinante y dos días después se aplicaron 300 µg de CFPE. Las vacunas se aplicaron por vía intradérmica en la tabla de cuello y 21 días después se revacunó bajo el mismo esquema. Todos los grupos fueron desafiados por vía intratraqueal, seis meses posvacunación y se sacrificaron seis meses posdesafío. Para la evaluación de citocinas, se establecieron 3 muestreos a diferentes tiempos, antes de la vacunación tiempo 0, el segundo 3 meses posvacunación y el tercero 6 meses posdesafío.
Ensayo de IFN-γ. La prueba de IFN-γ, se aplicó al inicio del experimento como prueba diagnóstica y para el monitoreo de la respuesta celular empleando un kit comercial). Se colocaron 1.5 ml de sangre con heparina en tres diferentes pozos, uno se estimuló con 100 μl de PPD bovino, otro con 100 μl de PPD aviar (ambos con 20 μl/ml) y un pozo no recibió estímulo. Las placas se incubaron 24 h, a 37 °C, en atmósfera húmeda al 5% de CO2. Los plasmas se recolectaron. Se colocaron 50 μl/pozo del plasma en las placas sensibilizadas con el anticuerpo monoclonal anti-IFN-γ bovino, se incubaron a temperatura ambiente por 1 h y posteriormente se lavaron con PBS-Tween 20 al 0.1% (solución de lavado).
Se agregaron 100 μl del conjugado (anti IFN-γ bovino marcado con peroxidasa) e incubó por 1 h. Nuevamente se hizo un lavado y se adicionó el sustrato 3,3᾽,5,5᾽ tetrametil-benzidina (TMB). Después de 30 min de incubación se adicionó la solución de paro (0.5 M H2SO4). La reacción se leyó a 450 nm y los resultados se calcularon considerando los promedios de DO450 de las muestras incubadas con PPD bovino, PPD aviar y sin antígeno (13).
Prueba de ELISA. Para la evaluación de la inmunidad humoral, se sensibilizaron placas con 5 µg de CFPE de M. bovis y M. avium por separado, en 100 µl de amortiguador de carbonatos pH 9.6 por pozo. Se incubó por 12 h a temperatura ambiente y se retiró la solución. Se lavó 5 veces con PBS al 0.1% de Tween 20. Se añadieron 100 µl de solución de bloqueo con 1% de leche descremada en solución de lavado, incubando por 1 h a 37º C. Se realizaron 5 lavados, posteriormente se añadieron 100 µl de cada suero problema diluido 1:100 en solución bloqueadora y se incubaron 1 h a temperatura ambiente.
Se realizaron 5 lavados, posteriormente se agregaron 100 µl de proteína G conjugada con peroxidasa diluida 1: 10 000 en solución bloqueadora, se dejaron incubar 1 h a 37º C y se lavaron 5 veces. Inmediatamente se añadieron 100 µl/pozo de solución de revelado (10 ml/placa de amortiguador de citrato-fosfato pH 4.5, 4 µg de orto – fenilendiamina y 4 µl de H2O2). La reacción se detuvo a los 15 min con 50 µl de solución de paro (H2SO4 2M). Las lecturas se realizaron a 492 nm (14).
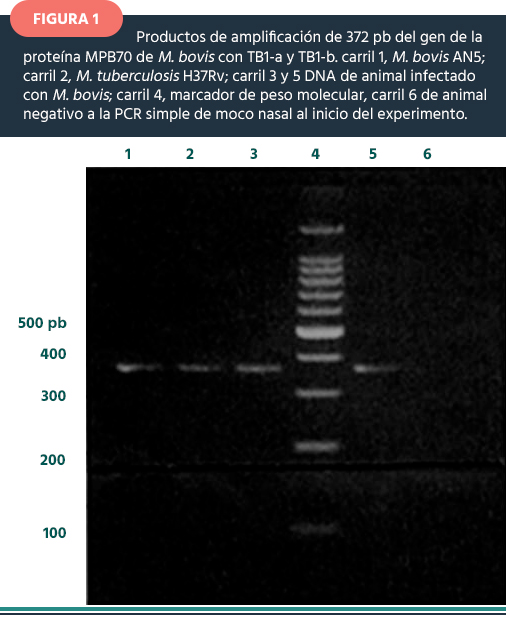
Prueba de PCR. Para el diagnóstico de TBb por reacción en cadena de la polimerasa (PCR), se extrajo el DNA de cada muestra de exudado nasal por el método de Van Soolingen et al (15). Para la PCR se empleó como control positivo, DNA de M. tuberculosis H37Rv y DNA de M. bovis AN5, como control negativo DNA de M. avium DN4 y agua Milli-Q. Se siguió el método descrito por Cousins et al (16). Los iniciadores para la PCR fueron TB1a 5´ CTC GTC CAG CGC CGC TTC GG 3´ y el TB1b 5´CCT GCG AGC GTA GGG GTC GC 3´, que amplifican el gen MPB70 con un tamaño de 372 pb, que identifica al complejo M. tuberculosis. Los productos fueron visualizados en geles de agarosa al 1.5% teñidos con bromuro de etidio al 1% (Figura 1).
Cultivo de células mononucleares de sangre periférica (PBMC). Para la evaluación de citocinas, se trabajó con PBMC, éstas se separaron por gradiente con Ficoll-Paque Plus a partir de sangre, centrifugando a 2800 rpm por 30 min. Se recuperó la interface de leucocitos y se adicionó solución de Hanks, nuevamente se centrifugaron a 2800 rpm por 10 min. Se adicionó RPMI 1640 con suero fetal bovino (FBS) al 10%. La suspensión celular se ajustó a 5×106 células/pozo. Los cultivos se estimularon con 100 μl de PPD bovino, 100 μl de PPD aviar (20 μg/ml), 2.5 μl de complejo 45-47 kDa (0.00125 μg/ml), 2.5 μl de Dip-z (.00125 μg/ml), 10 μl de concanavalina A (Con A) (1 μg/μl) y se dejó un pozo sin estímulo. Se incubaron por 72 h a 37°C en atmósfera húmeda al 5% de CO2.
Aislamiento de RNA total. Los cultivos de PBMC se recuperaron y se centrifugaron a 4 000 rpm por 5 min a 4° C, se adicionó 1 ml de Trizol (17). El RNA se extrajo con 200 μl de cloroformo-isoamílico, se centrifugó y se recuperó la fase acuosa. El RNA se precipitó con 500 μl de isopropanol. La pastilla se lavó con etanol al 100% y posteriormente se realizó un segundo lavado con etanol al 75% frío, el RNA fue resuspendido en 20 μl de agua DEPC, se calentó en baño María a 60° C por 10 min y se determinó la concentración empleando el Gene Quant (RNA/DNA calculator) (18).
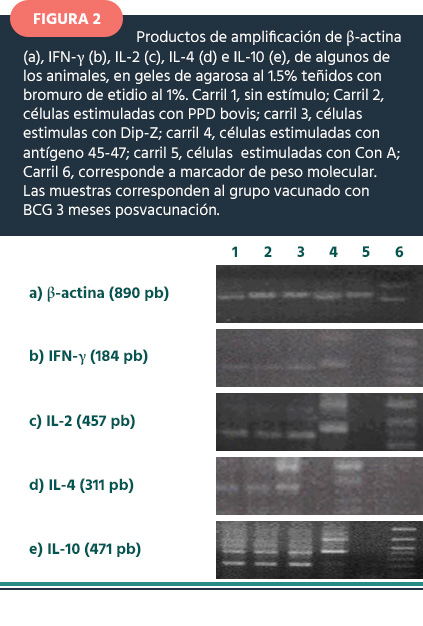
Evaluación de citocinas por RT-PCR. A partir del RNA total aislado de cada muestra se sintetizó el cDNA. Las reacciones de RT, se realizaron en un volumen final de 40 μl, la mezcla contenía 2 μl de Oligo d(T) 1 μg, 4 μl de 5X Fisrt-Strand Buffer (50 mM Tris-HCl, pH 8.3, 7 mM MgCl2, 40 mM KCl, 10 mM DTT); 4 μl de mezcla de desoxiribonucleótidos (dNTP: dGTP, dATP, dTTP, dCTP) 10 mM (1 μl de cada uno), 2 μl de RNAse Inhibitor 40 U, 2 μl de la enzima M-MLV Reverse Transcriptase y 250 μg de RNA total. La mezcla se sometió a un ciclo de RT a 70° C por 3 min, 37° C por 60 min y 70 °C por 15 min. El cDNA sintetizado se agregó a las reacciones de PCR que se llevaron a cabo en un volumen final de 25 μl. La mezcla fue 2.5 μl de amortiguador de reacción 10X (KCl 500 mM, Tris-HCl pH 8.3 100 mM, gelatina 10 μg/ml), 1.5 μl de MgCl2 20X (1.5 mM), 0.5 μl de desoxiribonucleótidos (dNTP: dGTP, dATP, dTTP, dCTP) (1:1:1:1) 10 mM, 0.5 μl de cada primer (10 pmol), 0.12 μl de Amplificasa ADN Polimerasa Termoestable ( 0.6 U), 4.5 μl de cada cDNA y agua DEPC cbp 25 μl (17). Los resultados de RT-PCR con la β-actina normalizada para la expresión de las citocinas, fue representada como la intensidad relativa de las bandas encontradas en los geles de agarosa teñidos con bromuro de etidio utilizando el software LabWorks 4.0 (19)(Cuadro 1, Figura 2).

Análisis estadístico. Los datos fueron analizados con el programa STATISTICA versión 5.5. Se realizó un análisis de varianza, seguido de una prueba de Tuckey para diferente tamaño de muestra (P<0.05), para comprobar si existían diferencias estadísticamente significativas.
Preparación de inóculo bacteriano para el desafío intratraqueal. La cepa de M. bovis No. 9930 aislada en campo, se cultivó en agar Middlebrook enriquecido con 10% de OADC (catalasa-dextrosa). Fueron seleccionadas de 3-5 colonias con morfologías semejantes y se crecieron en caldo Middlebrook 7H9 con 1% de OADC y 0.5 g/l de Tween 80, hasta obtener su fase logarítmica, y se ajustaron a 104 UFC/ml.
Criterios de evaluación de lesiones (post mortem). Se colectaron los linfonodos (LN) de cabeza (submandibular, retrofaríngeos y parótidos) y de tórax (mediastínicos y bronquiales). Las lesiones a nivel macroscópico fueron calificadas con un sistema de cruces de acuerdo al tamaño de las mismas. Se asignó (+) a las lesiones de ≥ 0.2 cm y ≤ 0.5 cm de diámetro, (++) a las lesiones de > 0.5 cm y < 1.0 cm y (+++) a las lesiones > 1.0 cm. (20).
Resultados
Al inicio del estudio, todos los animales de estudio fueron negativos a las pruebas PCC, IFN-γ, ELISA y PCR. La figura 1 corresponde a la PCR para la detección de M. bovis en muestras de moco nasal de los animales de estudio. En el carril 6 se observa una muestra negativa con sus respectivos controles.
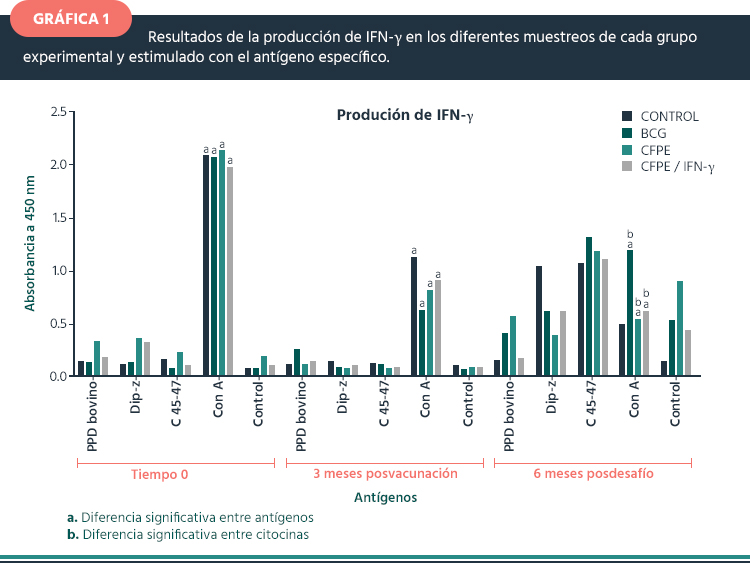
Ensayo de IFN-γ. Al tiempo 0, no hubo diferencia significativa entre grupos, sólo cuando se estimuló con Con A. Lo cual indicó que el estado inmunológico de todos los animales se encontraba en condiciones óptimas. Se observó 3 meses posvacunación en todos los grupos, con la disminución de la expresión de IFN-γ, con respecto al tiempo 0, cuando se estimuló con Con A. Es importante mencionar que preferentemente el grupo vacunado con BCG, presentó una menor expresión de IFN-γ bajo el estímulo de Con A, con diferencias significativas al resto de los antígenos. Bajo el estímulo de PPD bovino a los tres meses, la expresión del IFN-γ fue 2 veces mayor que con los otros antígenos. A los 6 meses posdesafío se observó una sobre expresión de IFN-γ con Dip-z y el antígeno 45-47 kDa. Sin embargo, en el grupo control estimulado con el antígeno Dip-z y el antígeno 45-47 kDa se favoreció la sobre expresión de esta citocina. Estos antígenos podrían ser usados como indicadores de una infección activa y temprana; caso contrario a lo que ocurre con el PPD bovino, que sólo permite evidenciar la infección latente. Los grupos vacunados con BCG y CFPE, mostraron mayor expresión de IFN-γ posdesafío, ante los diferentes antígenos (Gráfica 1)
Expresión de citocinas por RT-PCR.- Para el primer muestreo, los valores fueron obtenidos del promedio por grupo de la intensidad relativa porcentual en respuesta de las diferentes citocinas con respecto a â-actina del grupo control. En la figura 2, se observan los productos de amplificación de β-actina (890 pb), en gel de agarosa al 1.5 % teñido con bromuro de etidio al 1 %, correspondiente a las células sin estimular, utilizadas como control.
En la figura 2, se observan los productos de amplificación de β-actina (890 pb), IFN-γ (184 pb), IL-2 (457 pb), IL-4 (311 pb) e IL-10 (471 pb) de muestras de animales vacunados con BCG, estimulados con diferentes antígenos a los 3 meses posvacunación.
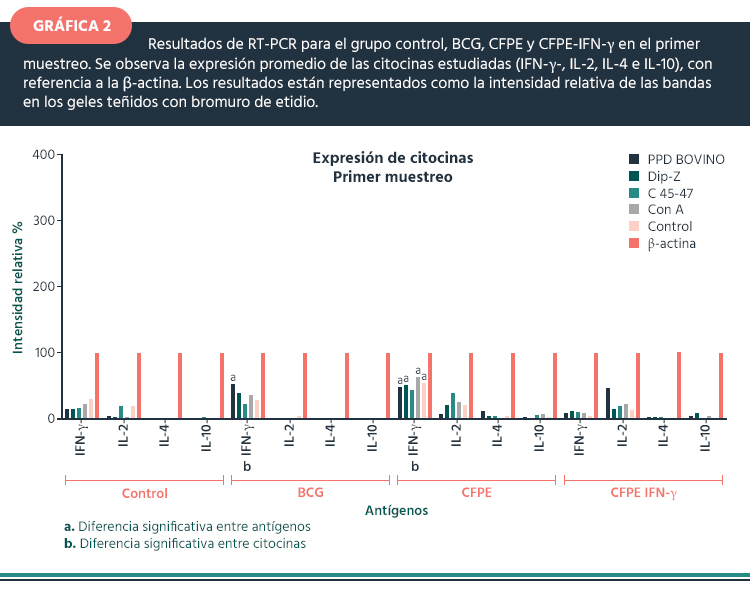
Primer muestreo. En la gráfica 2, se observa que al inicio del experimento, la expresión de IFN-γ es baja, lo mismo ocurre con IL-2, IL-4 e IL-10.
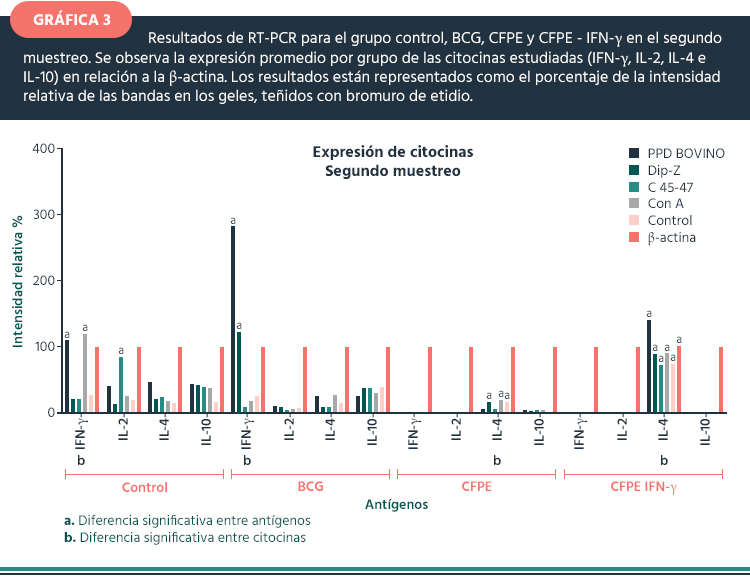
Segundo muestreo. En la gráfica 3, se observa una mayor expresión de IFN-γ (3 veces mayor que la β-actina) en el grupo vacunado con BCG y estimulado con PPD bovino, hay diferencia significativa con respecto a las otras citocinas del mismo grupo. En el grupo antes mencionado, la expresión de IFN-γ bajo el estímulo de Dip-z fue comparable con β-actina; sin embargo, la IL-10 se expresó 45% con respecto a la β-actina con todos los antígenos empleados, el resto de las citocinas estudiadas no mostraron diferencia significativa. Al mismo tiempo, pero en el grupo con CFPE–IFN-γ, la IL-4 se expresó de manera similar a la β-actina sin diferencia ante los antígenos, pero sí con diferencia significativa al resto de las citocinas (Gráfica 3).
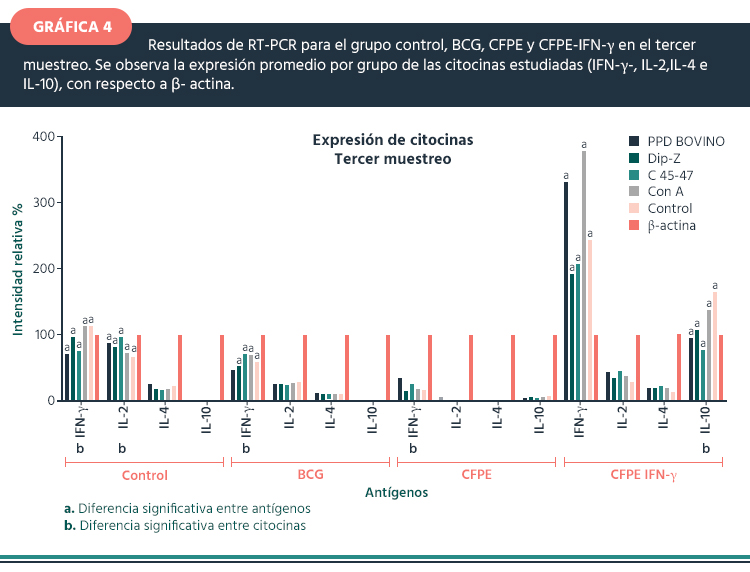
Tercer muestreo. En la gráfica 4, se observa la respuesta de las diferentes citocinas al estímulo con los antígenos, donde IFN-γ e IL-2 mostraron una sobre expresión ante todos los antígenos evaluados, principalmente en el grupo control, con respecto al grupo con BCG y CFPE+IFN-γ donde la expresión de IL-2 fue menor. En este último grupo, la sobreexpresión de IL-10 fue muy evidente. Respecto a la expresión de IL-4 que fue mínima o nula en los diferentes grupos.
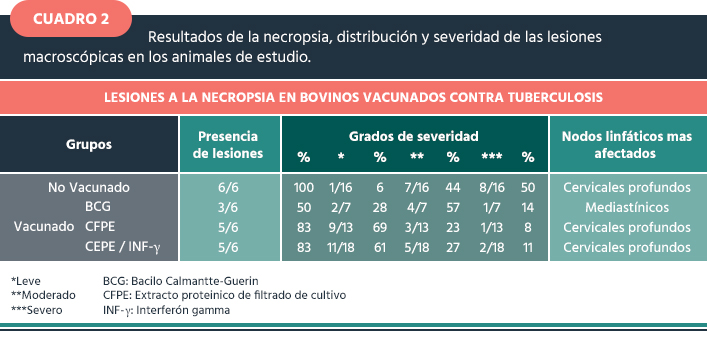
Inspección post mortem de los linfonodos (NL) y zona de inoculación. El grupo control (no vacunado) mostró el mayor número y severidad de lesiones en todos los animales (6/6), con un 100% de presencia de lesiones. El tipo de lesión observada fue linfadenitis supurativa, con amplia diseminación, los NL más afectados fueron los cervicales profundos, observándose lesión en cuatro animales, con un diámetro > 2.5 cm. El grupo 2 vacunado con BCG, presentó menor número de lesiones y menos severas. Tres animales totalmente libres de lesiones (3/6); es decir, un 50% con lesiones primordialmente leves, un animal con lesión en la zona de inoculación, un animal con lesión única en NL mediastínicos < 0.7cm y otro animal con pequeñas lesiones en NL cervicales profundos y mediastínicos < 0.3 cm. En lo que corresponde al grupo 3, inmunizado con CFPE de M. bovis, las lesiones fueron menos extensivas (5/6) con un 83% de lesiones primordialmente leves y de menor grado en los NL, la mayoría de ellas muy localizadas, cercanas a la zona de inoculación y la lesión fue de linfadenitis supurativa. En el grupo 4 inmunizado con CFPE-IFN-γ, un animal se encontró libre de lesiones a TBb; los demás animales, sí mostraron lesiones, comparado con el grupo control las lesiones no fueron tan frecuentes, se encontraron localizadas y fueron menos severas y de menor tamaño (Cuadro 2).
Discusión
Durante el establecimiento de una respuesta inmunitaria específica en la TBb, participan una gran cantidad de poblaciones celulares y una amplia red de mediadores solubles (citocinas), el éxito en la eliminación del bacilo, depende de una correcta integración de las defensas del hospedador hacia infecciones intracelulares, donde se involucra una respuesta inmune innata, así como una inmunidad adaptativa mediada por células. El control inmunológico de la infección por M. bovis, está basado primordialmente en una respuesta de células T tipo 1 (Th1). La protección inmunitaria específica contra M. bovis se inicia tras la activación de linfocitos T CD4+, capaces de secretar IFN-γ, pero existen otras subpoblaciones celulares involucradas durante la infección en la TBb, como linfocitos T CD8+, linfocitos Tγδ y células dendríticas, que están involucrados en la respuesta temprana y proveen una rica fuente de citocinas como IFN-γ e IL-2 (21).
Para este trabajo, seleccionamos becerras de 6 meses de edad, ya que en otros trabajos se ha reportado la importancia de la edad de los animales al momento de la inmunización con BCG, ya que juega un papel muy trascendental para que se pueda desarrollar una inmunidad protectora en esta y otras enfermedades, ya que entre menor sea la edad a la cual se aplique la vacuna, mayor será el rango de protección (22). En cuanto al desafío, aplicamos una dosis de 104 UFC, de tal manera que semejara una infección natural, reportes previos indican que dosis bajas, inducen una respuesta Th1(23).
Con respecto a la producción de IFN-γ, no fue evidente tres meses posvacunación; sin embargo, seis meses posdesafío, el grupo vacunado con BCG estimulado con el complejo 45-47, presentó los niveles más altos de IFN-γ, a este siguió Dip-z y finalmente PPD bovino. En el grupo vacunado con BCG se indujo una respuesta inmune protectora, donde se correlacionaron los niveles de producción de IFN-γ con el patrón de respuesta de las citocinas que se enfocó hacia Th1. Se ha determinado que BCG es un potente estimulador de células CD4+ y un pobre estimulador de células CD8+ (24). Se ha descrito que la BCG induce una elevada producción de IFN-γ e IL-2 (23).
La expresión de IFN-γ en bovinos, ha sido observada 2 semanas después de haber sido vacunados con BCG, induciendo protección (13), por lo que es esencial para la promoción de la protección inmunológica contra la tuberculosis bovina (25). Así mismo, la dosis de vacunación con BCG se encontró dentro de los rangos recomendados para conferir protección, ya que algunos autores mencionan que dosis menores inducen mejor protección (26). Con el uso de la BCG, los bovinos tienen hasta un 75% de protección contra la infección experimental intratraqueal con M. bovis (23), también les confiere protección contra el desarrollo de lesiones, así como la reducción en el tamaño de las mismas (27), como ha sido demostrado en nuestro experimento, ya que en la inspección post-mortem, tres animales no tuvieron ninguna lesión y el resto de los animales, desarrollaron lesiones moderadas.
Conclusiones
La vacuna BCG indujo una buena expresión de IFN-γ e IL-2, por lo que hace pensar que hoy día sigue confiriendo una buena protección y en un segundo lugar la vacuna con CFPE. No existió un adecuado sinergismo entre el CFPE e IFN-γ, a pesar de ser este último pieza clave en la IMC para lograr una correcta protección contra la enfermedad.




























































































